清华开发高通量干细胞微球3D打印机,并揭示干细胞的再生修复机制
据统计,中国每年因为交通事故等意外伤害导致的死亡人数约为 10 万人。其中,大面积组织器官创伤是致死的原因之一。
另外,中国每年约有 2000 万人遭遇不同程度的烧伤,5% 左右的受伤者需要住院治疗,以对受伤组织进行修复。
但是,如何实现大面积组织器官的有效再生修复,依然是临床上悬而未决的难题。
作为人体的“原材料”,干细胞可以产生所有具有特殊功能细胞。它具备多向分化的潜能,通过定向诱导可以分化成特定的组织或器官,具备良好的再生修复能力。
当前,临床主要采用干细胞注射法,来对器官进行再生修复。即通过提取脐带血内的间充质干细胞,制备成干细胞悬液,然后将悬液注射到受损的器官部位,从而实现修复。
然而,这种方法的细胞留存率较低。注射几小时后,干细胞在体内的留存率小于 5%[1],干细胞活性也会迅速下降,难以满足临床对于干细胞数量和质量的要求。
在临床上,每平方厘米的受损器官需要约 100-300 万干细胞,并且干细胞的干性需要维持在 90% 以上。
此外,间充质干细胞一般来源于脐带血、脂肪、骨髓等原代组织,存在扩增效率低、扩增周期长、耗时久等特点。
总体来说,干细胞在向临床转化的过程中,依旧面临着质量不可控、留存效率低、价格高昂等问题,极大地阻碍了产业化的进程。
此前,学界已经研发出若干对策。比如,将干细胞固定在生物活性支架上,从而提升干细胞的稳定性和留存率。
而对材料进行改性设计、以及修饰功能基团,能让生物活性支架充分地模拟人体内部的细胞外基质微环境,为干细胞生长提供良好的“土壤”。
此外,采用干细胞微球填充式移植法,可以提升营养物质在生物活性支架内部的运输效率,为干细胞生长提供更丰富的营养物质。
生物 3D 打印技术,也是人们想到的对策之一。它是一种新型的增材制造技术,可以实现生物活性因子、细胞、生物支架在三维空间下的有序排列,提升放生器官的制备效率,并能降低人为因素对于组织器官构造的影响,有望解决器官短缺、供体不足、以及大面积创伤后的原位再生修复等难题。
然而,当前的生物 3D 打印技术对于“生物墨水”的可打印性要求较高。粘度较高的“生物墨水”可打印性更佳,但是生物活性较差;而粘度较低的“生物墨水”的生物活性更优,也能促进细胞的生长、增殖与分化,但是机械性能较低,难以实现对软组织的生物 3D 打印。

破局:清华团队研发喷气式高通量干细胞微球 3D 打印机
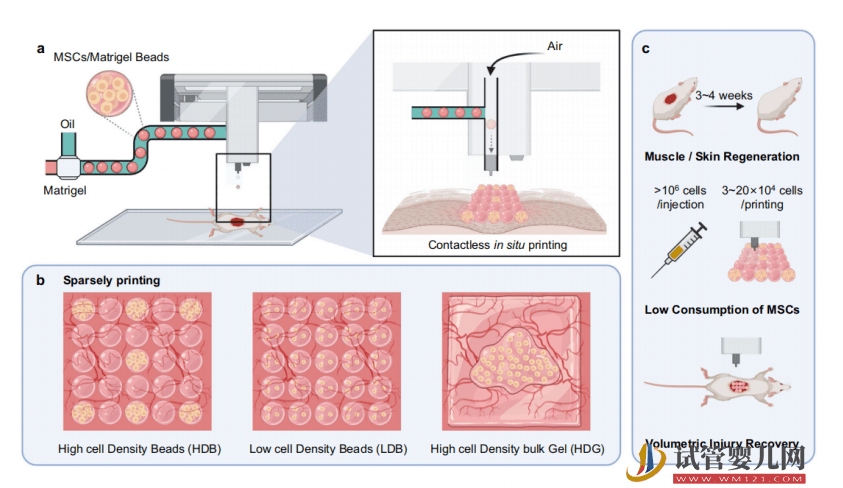
为解决上述问题,清华大学深圳国际研究生院生物医药与健康工程研究院副教授马少华和团队,研发出一款喷气式高通量干细胞微球 3D 打印机,并提出高密度干细胞微球间隙式的移植技术。
 (来源:Nature Communications)
(来源:Nature Communications)
目前,课题组正准备与多家医院开展合作,打算试点投放这款打印机,以在创伤修复、组织再生、癌症药筛等领域开展临床试验。
该成果的优势在于,可以提升干细胞的利用率和可移植面积,实现干细胞微球在受损器官部位的原位 3D 打印,并能成功修复重度骨骼肌创伤。
同时,还能实现毛囊的再生,有望用于大面积皮肤创伤和软器官损伤修复。而且,全自动化的 3D 打印流程,还能解决当前医疗资源匮乏等问题。
借助这款打印机,在大面积皮肤烧伤的修复上,研究人员已对缺少 40% 表皮的小鼠皮肤实现了再生修复。
 (来源:Nature Communications)
(来源:Nature Communications)
未来,打印机还能内嵌不规则创面 3D 扫描仪,对不规则创面进行 3D 扫描重建,实现对于不规则创面组织的全自动化 3D 打印。
再通过原位生成干细胞微球、创伤区域扫描重建、干细胞微球原位 3D 打印等手段,就能对大面积烧伤病人进行再生修复。
在脂肪填充等美容领域,干细胞微球间隙式移植技术可以同时移植干细胞微球和无细胞微球,通过干细胞的高迁移性,能从宏观层面上实现干细胞利用率的最大化。
未来,干细胞微球和无细胞微球还有望形成干细胞微球组,从而用于脂肪填充,锁住脂肪以避免其流失。同时,干细胞微球组还具备抗老化的功能,故也能用于美容等领域。
近日,相关论文以《喷气式打印使稀疏间充质干细胞图案化增强骨骼肌和毛囊再生》(Bead-jet printing enabled sparse mesenchymal stem cell patterning augments skeletal muscle and hair follicle regeneration)为题发表在 Nature Communications 上 [2]。
 图 | 相关论文(来源:Nature Communications)
图 | 相关论文(来源:Nature Communications)
清华大学清华-伯克利深圳学院 2019 级硕士生曹远雄是第一作者,马少华担任通讯作者。论文也被期刊编辑选取为 Biotechnology and methods 领域内的亮点文章。
 图 | 从左至右:马少华、曹远雄(来源:资料图)
图 | 从左至右:马少华、曹远雄(来源:资料图)

1 月内实现功能性修复,3 周内实现毛囊再生
据介绍,该团队长期致力于研究干细胞与类器官工程,曾发明一款级联微流控微球制备技术,并已用于高通量肿瘤类器官制备、子宫内膜与肝脏修复。
基于此,他们实现了高通量、自动化的“智能化类器官-个体敏感药物筛选”技术,将筛药周期缩短至 1 周内,通量提高 10 倍以上。另外,其还曾研制一款类器官工程化的原创装备。
而此次的喷气式高通量干细胞微球 3D 打印机,则是级联微流控微球制备技术,在再生医学领域的又一探索。(来源:Nature Communications)
 (来源:Nature Communications)
(来源:Nature Communications)
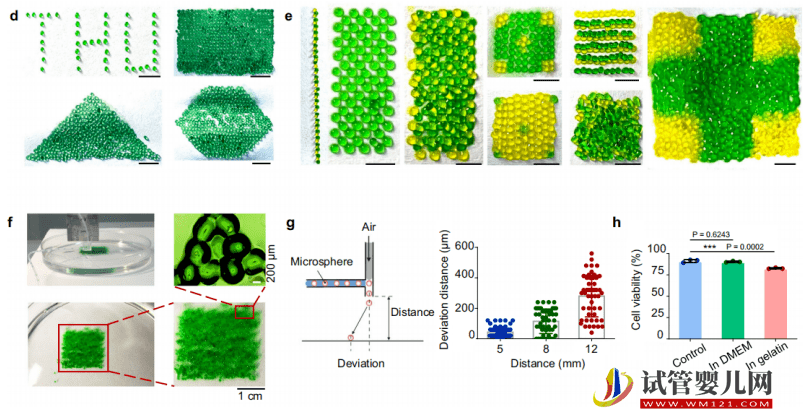
研究中,课题组耗时两年左右完成从原型机到实验室样机的设计、优化、调试与组装。其采用模块化的设计思路来搭建 3D 打印样机,只需先完成分模块的调试,在所有模块都完成优化后,再组装起来进行整体样机的全局匹配与调试。
打印机内嵌以下模块:微流控制备模块、3D 打印模块、图像捕捉模块、以及微球喷射模块,涵盖生物、机械、材料、信息等多学科。
接下来,要对高密度干细胞微球间隙式移植技术进行体外测试,包括测试干细胞的生物活性、安全性、相容性等。
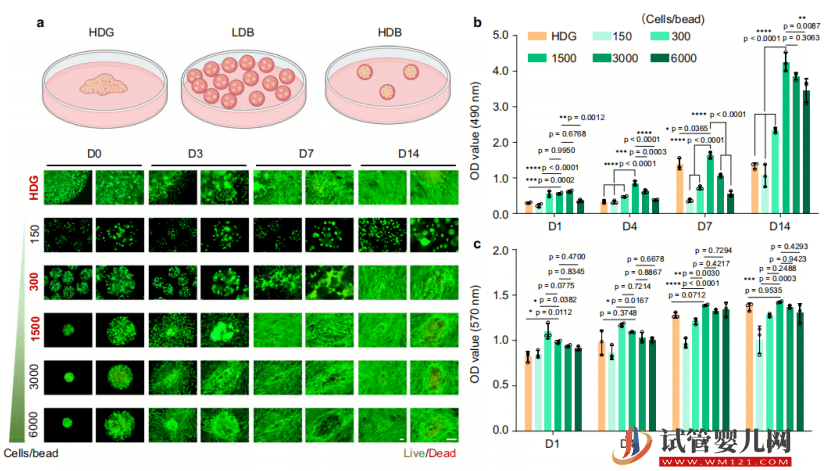
然后,他们还测试了不同细胞密度的增殖活性,借此筛选出最适合干细胞生长的细胞密度。
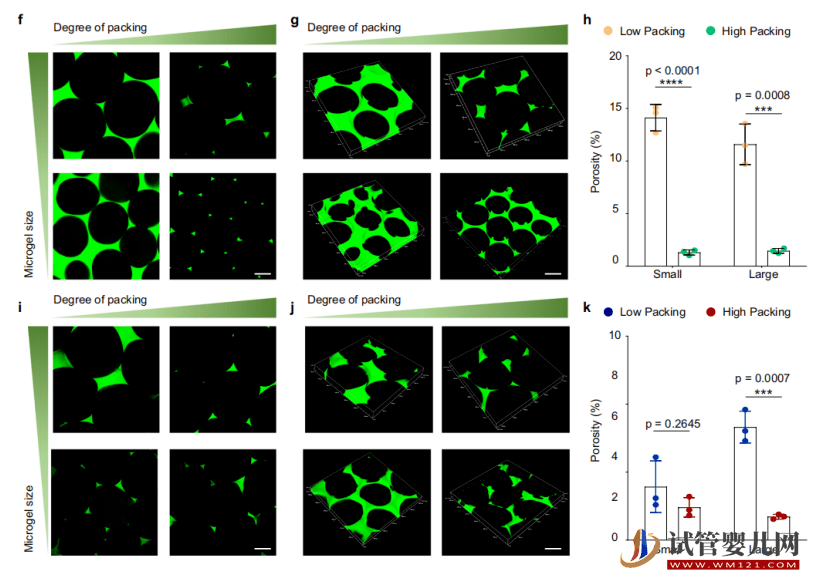
随后,针对不同干细胞密度微球在迁移能力、代谢能力、干性维持能力以及外泌体分泌能力的区别进行比较,借此发现高密度干细胞微球可以提升干细胞生物活性、安全性和相容性。
下一步,则要测试打印机在重度骨骼肌创伤和毛囊再生修复上的效果。其中最重要的一项测试在于,对动物体内的组织创伤进行再生修复。
为此,他们选取不同的组织,来测试打印机的修复性能。对于重度骨骼肌的创伤,在 1 个月内实现了功能性修复;对于小鼠毛囊的损失,则在 3 周内实现了毛囊再生。
实验结果表明,在损失组织的原位打印与再生上,这款打印机有着优良的性能。
但在当时,干细胞的再生修复机制仍然是个未解之谜。不过做科研本就需要迎难而上,课题组也决心阐释干细胞体内的修复机制,这也是研究中最难的部分。
通过大量文献调研,他们发现旁分泌作用和分化,是干细胞发挥作用的潜在机理。
为此,该团队采用荧光标记法,对干细胞进行荧光标记与示踪,然后将标记好的干细胞植入到体内,并在不同的时间点提取再生组织、进行组织切片与荧光成像,最终确定了干细胞在体内发挥的作用机制:即在植入干细胞的前期,干细胞会通过增殖与旁分泌发挥作用;在植入干细胞的后期,干细胞会通过分化来发挥作用。针对这一机理的解释,也得到了三位审稿人的认可。
 (来源:Nature Communications)
(来源:Nature Communications)

再接再厉:即将研发人工合成生物活性支架
另据悉,研究初期该团队原本打算采用快速热喷法,实现干细胞微球的无接触打印,通过瞬时高温产生的气体膨胀,促成干细胞微球的喷射。
随后,第一代原型机的设计与加工终于完成,其集成微流控模块、3D 打印模块、温控模块以及喷射装置。
后来,他们测试了上述原型机的生物安全性,通过将干细胞微球快速热喷射入培养基,并进行活死细胞染色。
测试结果表明,80% 以上的细胞因为瞬时加热而死亡,对于这款原型机的生物安全性来说,这是一项极大的挑战,也意味着将近一年的努力付诸东流。
但是研究团队并没有气馁,再次翻阅大量文献之后,他们决定改变思路研发第二代原型机,即通过采用高速流气体,实现干细胞微球的 3D 打印。
鉴于上次的经验教训,他们把生物安全性作为首要的考虑因素,在初期就测试了高速流气体对于干细胞微球的活死影响。
结果显示,高速流气体有着极高的生物安全性,气体推动所产生的喷射力,对于干细胞微球的活死不会有任何影响,这也让接下来的工作得以延续。最终完成了本次研究。
未来,他们还打算研发新型的人工合成生物活性支架,预计它能充分模拟细胞外基质微环境,并有望替代当前已有的商用基质胶产品。





